|
|
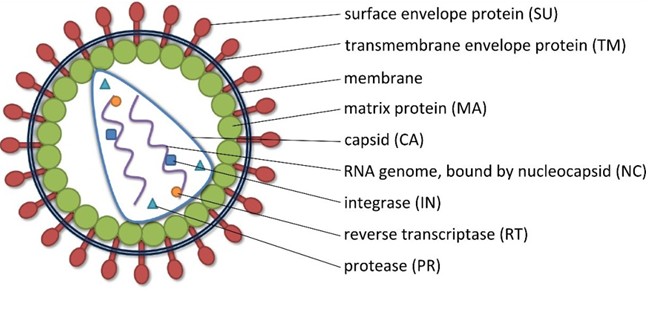
慢病毒包装 Lentivirus translation 实验原理 慢病毒属于逆转录病毒科,名称源自该种病毒长达数年的潜伏期,其中最为人所知的是人类免疫缺陷病毒(HIV-1)。HIV-1直径约120nm,含两条正链RNA,可有效的进入细胞核中,对分裂期细胞及非分裂期细胞均具有很高的感染效率。对以HIV-1为基础进行的慢病毒载体的改造,主要是去除致病基因减少辅助质粒与载体质粒的同源性,最终体现在滴度、生物安全性和外源基因表达效率上的提高,见结构示意图。
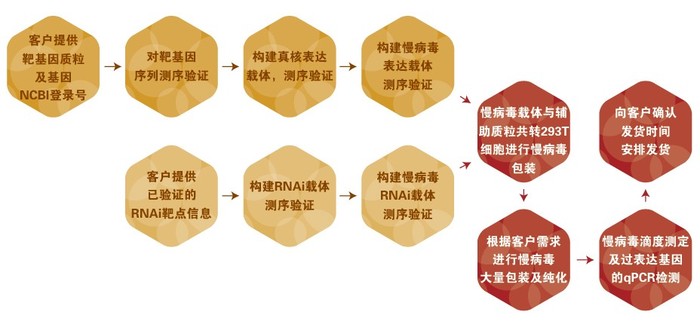
图3.6慢病毒结构示意图(转载自www.labome.com) 技术应用 体外实验多用于感染各种难题转染细胞,建立稳定表达或沉默目的蛋白的细胞株。 体外实验可用于基因治疗、动物模型的制备等。 实验流程
病毒提供规格
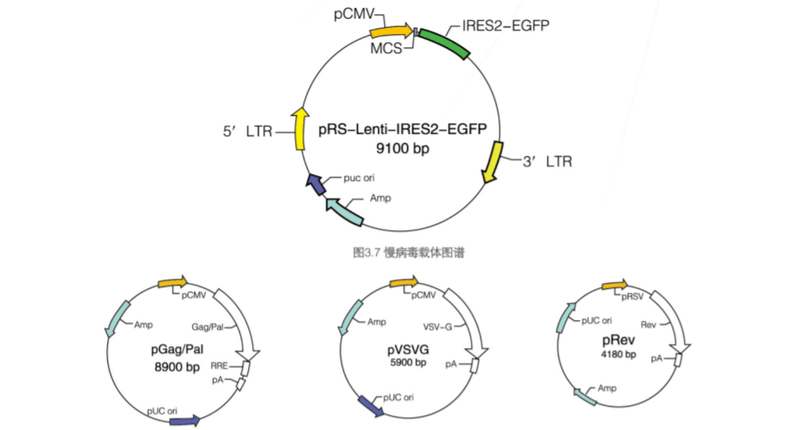
载体图谱
图3.8慢病毒辅助质粒载体图谱 实验结果展示
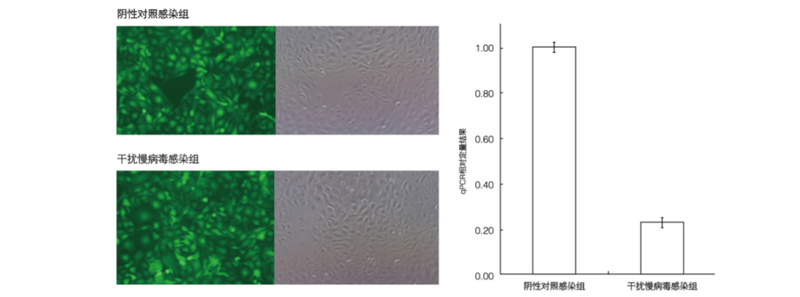
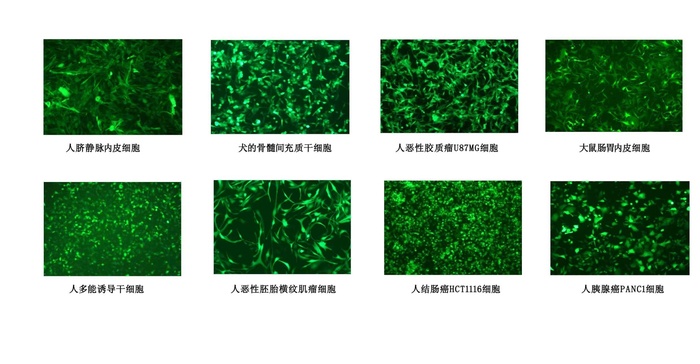
图3.10慢病毒感染各种细胞图片展示 TROUBLESHOOTLNG
常见问题 FAQ Q:根据文献选择慢病毒感染效率应该没问题,为什么要做细胞感染预实验? A:常见的慢病毒和腺病毒以感染谱广和效果高而著称,但是具体到不同细胞,他们对不同病毒类型的感染效率都是不一样的,甚至于不同实验室的相同名字的细胞对同种病毒的感染效率也是有不同的(因为细胞在不断传代之后,遗传背景已经发生了变化)。在没有判断该细胞的最佳感染病毒类型就贸然选择病毒是存在风险的。即使后续的细胞实验是客户自己完成,我们也需提醒客户规避可能的风险。 Q:什么是MOl值?如何进行MOl值摸索? A:MOl(Muitiplicity Of Infection,感染复数)是指病毒感染细胞的比例。选择合适的MOl值,病毒的感染效率以及目的蛋白的表达量越高,相对细胞的毒性越小。对于分裂活跃的细胞,比如293细胞,MOl=1时,95%以上的细胞均可以表达目的基因。而对于非分裂细胞,比如原代细胞,感染效率较低,MOl值可能达到200-300.我们建议通过比较不同MOl(比如0、1、5、10、50、100等)感染细胞的结果(注意摸索是否需要填加polybrene),现在适合的MOl进行实验:可以先将培养好的细胞接种至96孔板,然后用携带报告基因EGFP的阴性对照慢病毒,按照不同MOl值比例感染细胞,进行MOl值摸索。 Q:慢病毒使用的安全性如何? A:慢病毒已经被全世界许多实验室应用,至今没有生物安全性出现问题的报道,但仍具有潜在的产生复制型慢病毒和致癌的风险,操作者在实验中仍需要保持高度警惕!所有操作均应尽量在生物安全2级实验室的安全柜中进行,并佩戴一次性口罩和手套,尤其要避免病毒接触口、眼、鼻、耳、伤口等身体开放性区域,避免产生气溶胶。显微镜台、生物安全柜台面等使用后,用75%乙醇擦拭。意外洒落的含病毒的液体,用卫生纸吸干后,用0.6%次氯酸钠溶液浸泡被污染处1h。对共用实验室的人员进行慢病毒安全培训或提示。 Q:在慢性毒介导的稳转株构建实验中,慢病毒感染细胞后,整合入基因组中的位点有多少? A :慢病毒的整合和加入的病毒量有关,加入量很多如MOI值达到100时可以进行多位点整合,最多5-10个,注意表达量的高低和整合位点与其在染色体上的位置有关。质粒很可能是整合在转录活性不强的区域,而慢病毒的偏好性在于转录活性非常强的区域。 Q:对于片段特别大的外源基因,载体构建和病毒包装是否存在困难? A:基因超过2500bp,如果还要增加1300bp大小的IRES-GFP,则大小将超过3500bp。因此如果基因太大,可以考虑不要加IRES-GFP序。基因过长对于慢性毒载体的构建会造成一定的困难,如扩增产生点突变的几率增加,扩增酶切回收效率不高;另外基因越大,病毒包装效率过低可能导致病毒包装失败。 Q:订购到的慢病毒如何保存和使用? A :包装好的慢病毒液全程采用干冰运输,快递至客户处。请务必注意查收,收到后请打开包装检查干冰是否还有剩余,病毒种类和规格是否发货单完全一致。请将慢病毒液在-80摄氏度保持,避免反复冻融,6个月内滴度不会明显下降,建议尽快使用完毕。对于保持6-12个月以上的样品,实验前需重新测定滴度。使用前从-80摄氏度冰箱取出病毒,置冰上融解,待用。一次用不完的病毒液可以放在4摄氏度冰箱 中,一周内使用完毕。 Q:腺病毒和慢病毒的区别各有哪些?
Q:可以对miRNA的成熟序列进行慢病毒包装工作吗? A:可以,请提供miRNA的成熟序列的序列信息即可。我们将进行miRNA过表达慢病毒载体的构建、包装、滴度检测及miRNA的qPCR检测,详情请见第七章技术服务内容。 参考文献 1.Buchschacher GL Jr, Wong-Staal F.Development of Lentiviral Vectors for Gene Therapy for Human Diseasea. Blood2000,95(8):2499-2504. 2.Pandya S, Klimatcheva E, Planelles V. Lentivirus and foamy virus vectors: novel gene therapy tools Expert Opinionon Biological Therapy 2001,1(1):17-40. 3.Park F, Kay MA.Modifred HIV1 based lentiviral vectors have an effect on viral transduction efficiency and geneexpression in vitro and in vivo. Mol Ther 2001,4(3):164-173. |